Die Dyker-Vorlesung
Die Vorlesung "Organische Chemie I" von Prof. Gerald Dyker an der Ruhr-Universität Bochum ist komplett als Reihe von Videos im Internet erhältlich. Diese Vorlesung ist für engagierte Schüler der gymnasialen Oberstufe sehr zu empfehlen. Für die Nucleophile Substitution sind vor allem die Vorlesungen 1.17 und 1.18 interessant. Ein paar Probleme und Aufgaben, die Prof. Dyker seinen Studenten dort gestellt hat, möchte ich hier so erläutern, dass auch engagierte Schüler eines Chemie-GKs oder LKs davon etwas haben.
Reaktion von 2-Brom-2-Methyl-propan mit Wasser
 Reaktion von 2-Brom-2-Methyl-propan mit Wasser zu 2-Methyl-propan-2-ol
Reaktion von 2-Brom-2-Methyl-propan mit Wasser zu 2-Methyl-propan-2-ol
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
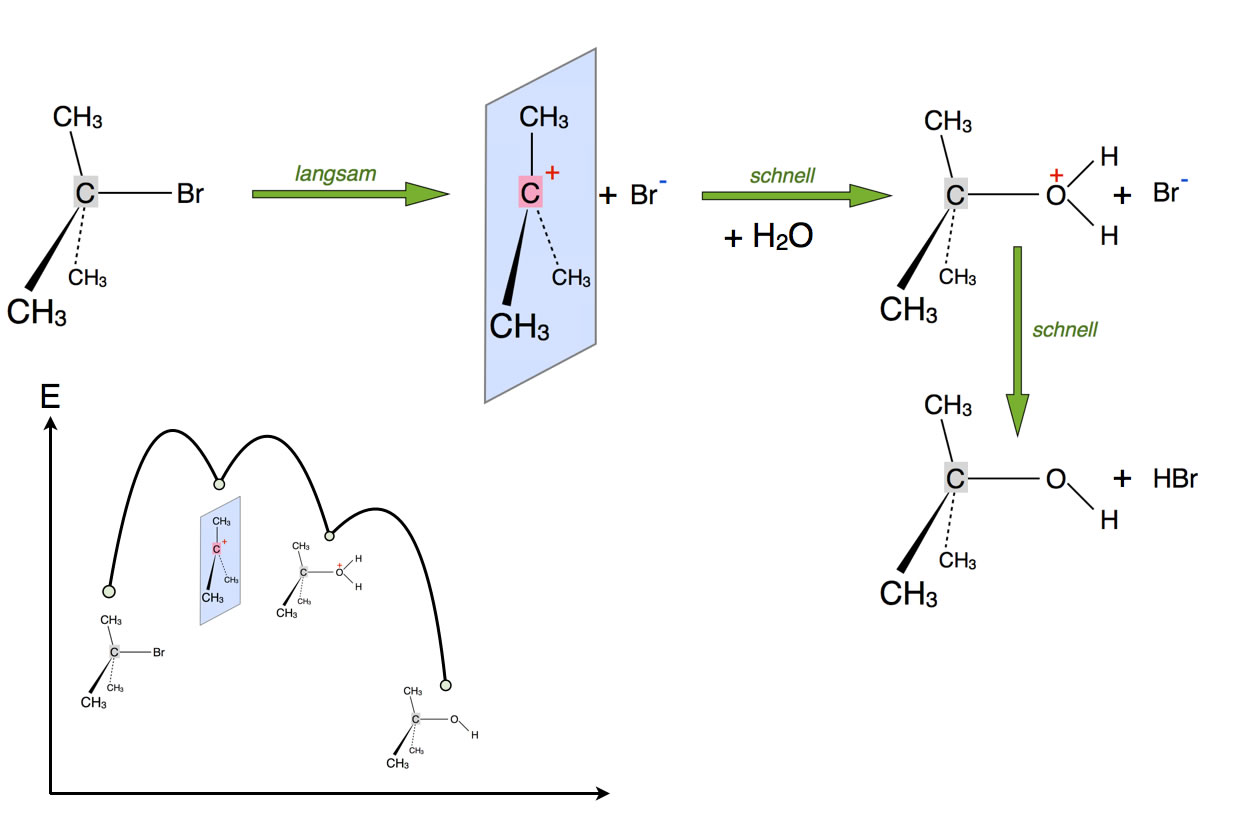
Die Abbildung 1 zeigt noch kein Problem und gehört auch zu keiner Aufgabe, sondern ist eine nähere Betrachtung der Substitution eines Halogen-Atoms durch eine Hydroxygruppe nach dem SN1-Mechanismus.
Diese Reaktion läuft nämlich nicht in zwei Schritten ab, sondern in drei. Im ersten langsamen Schritt bildet sich das pentavalente Carbenium-Ion, an das sich dann im schnellen zweiten Schritt ein Wasser-Molekül anlagert. Die Oxonium-Gruppe in diesem Zwischenprodukt ist aber noch recht instabil. Durch Abspaltung eines Protons bildet sich dann im schnellen dritten Schritt das Endprodukt 2-Methyl-propan-2-ol.
Diese Reaktion ist übrigens vollständig reversibel. Durch saure Katalyse kann man die OH-Gruppe eines Alkohols in eine Oxonium-Gruppe verwandeln, die dann leicht als Wasser-Molekül abgespalten werden kann, vor allem dann, wenn das Resultat ein tertiäres Carbenium-Ion ist. An dieses Carbenium-Ion kann sich dann leicht ein Bromid-Ion anlagern.
Problem 1
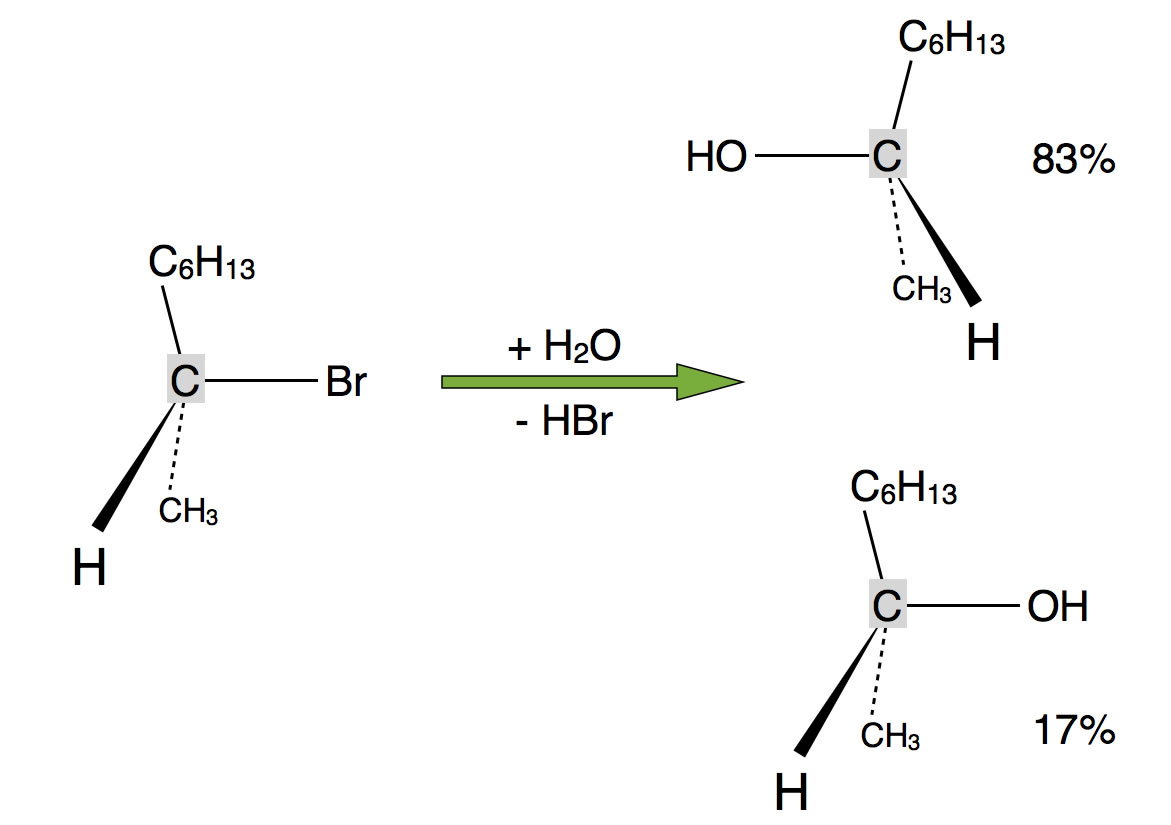
Kommen wir zum ersten Problem, das in der Dyker-Vorlesung 1.18 behandelt wird. Schauen Sie sich dazu folgende Graphik an:
Es bilden sich zwei Enantiomere (Spiegelbild-Isomere), allerdings in sehr asymmetrischem Verhältnis, nämlich 83% zu 17%.
Würde die Reaktion nach dem SN2-Mechanismus ablaufen, so müsste sich das eine Spiegelbild-Isomer zu 100% bilden, wegen der mit dem Mechanismus verbundenen Inversion.
Würde die Reaktion nach dem SN1-Mechanismus ablaufen, wäre ein Racemat zu erwarten, also ein 50:50-Gemisch der beiden Enantiomere. Das Carbenium-Ion, das sich im ersten Reaktionsschritt bildet, ist ja planar und somit von beiden Seiten für das Nucleophil zugänglich.
Wie aber kommt die eigenartige Zusammensetzung 83:17 zustande?
Eine erste Hypothese ist die, dass beide Mechanismen gleichzeitig ablaufen bzw. miteinander konkurrieren. So könnte 66% des Produktgemische durch eine SN2-Reaktion zustande kommen, und 34% durch eine SN1-Reaktion. Die SN1-Reaktion würde dann je 17% der beiden Enantiomeren liefern, und wenn man diese 17% zu den 66% addiert, kommt man auf genau 83% für das eine Isomer.
Untersucht man allerdings die Kinetik der Reaktion, so zeigt sich, dass die Reaktionsgeschwindigkeit nicht von der Konzentration des Nucleophils abhängt. Ein SN2-Mechanismus findet also nicht statt.
Die Lösung des Rätsels: Das entstandene Carbenium-Ion (SN1-Mechanismus) ist derart reaktiv, dass es sich mit dem Nucleophil bereits verbindet, wenn sich das Bromid-Ion noch nicht sehr weit von dem zentralen C-Atom entfernt hat.
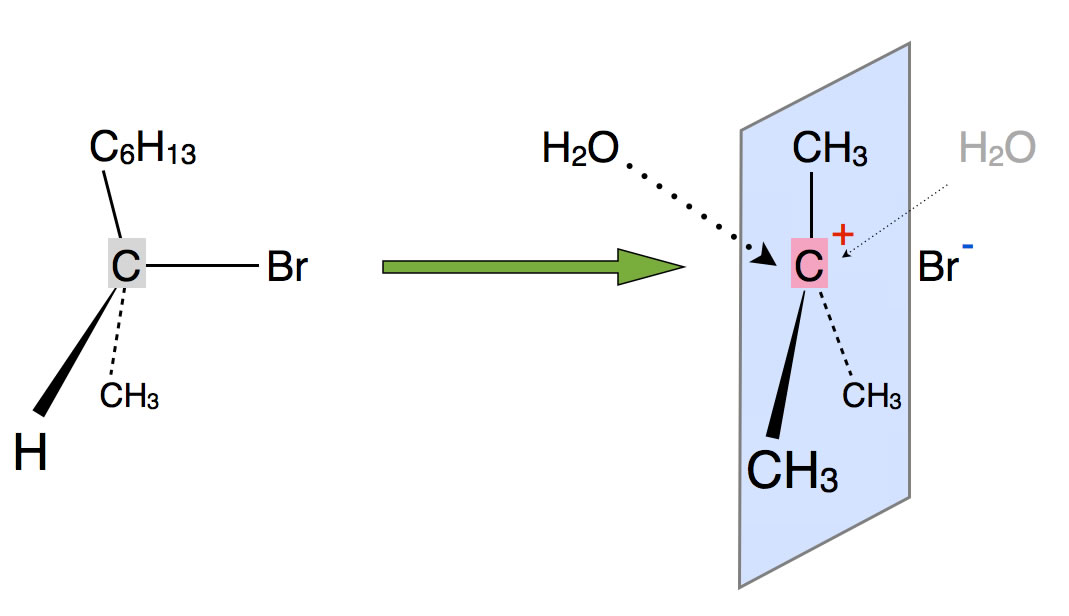
Das Carbenium-Ion kann von der einen Seite leichter nucleophil angegriffen werden als von der anderen Seite
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Das Bromid-Ion behindert den nucleophilen Angriff sterisch, das Carbenium-Ion kann von der einen Seite leichter von den Wasser-Molekülen angegriffen werden als von der anderen Seite.
Den Komplex aus Carbenium-Ion und noch nicht ganz abgelöstem Bromid-Ion nennt Prof. Dyker in seiner Vorlesung (Folge 1.18 bei YouTube) übrigens Kontakt-Ionen-Paar. Weitere Einzelheiten dazu finden Sie auf der Expertenseite "Das Konzept der Ionenpaare" auf dieser Homepage. Auch die Expertenseite "Lebensdauer von Carbenium-Ionen" ist in diesem Zusammenhang ganz interessant.
Problem 2
Betrachten wir noch einmal folgende Tabelle:
| Organisches Edukt | Geschwindigkeit der SN2 | Geschwindigkeit der SN1 |
| H3C-X | schnell | extrem langsam |
| RCH2-X | schnell | langsam |
| R2CH-X | gemäßigt | gemäßigt |
| R3C-X | langsam | schnell |
Interessanterweise läuft bei den sogenannten Allylhalogeniden sowohl der SN1-Mechanismus wie auch der SN2-Mechanismus recht schnell ab.
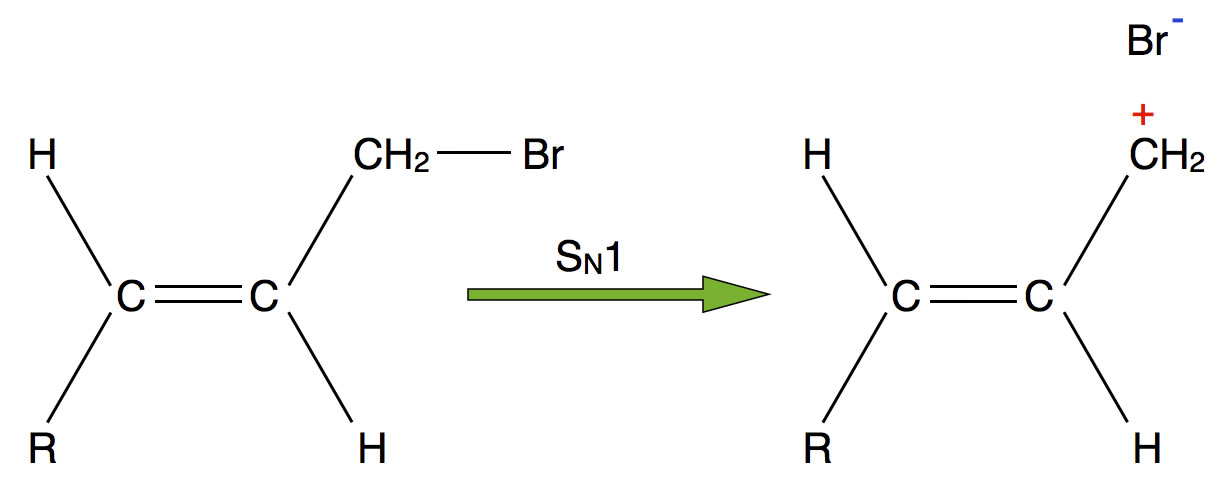
Erster Schritt der SN1-Reaktion eines Allylbromids
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Das beim ersten Schritt der SN1-Reaktion gebildete Carbenium-Ion wird nicht nur durch den positiven induktiven Effekt des R-CH=CH-Restes stabilisiert, sondern auch durch die Überlappung der pz-Orbitale der drei C-Atome. Beide C-Atome der C=C-Doppelbindung besitzen ja ein pz-Orbital, und das C-Atom des Carbenium-Ions ist bekanntlich sp2-hybridisiert und hat daher ebenfalls ein pz-Orbital. Diese drei pz-Orbitale können nun überlappen, und die darin befindlichen Elektronen sind delokalisiert, was die Stabilität des Kations grundsätzlich erhöht. So wird die hohe Reaktionsgeschwindigkeit der SN1-Reaktion verständlich.
Die ebenfalls hohe Reaktionsgeschwindigkeit der SN2-Reaktion muss eigentlich nicht näher erklärt werden; das Brom-Atom sitzt an einem primären C-Atom, und laut obiger Tabelle bedingt das eine hohe Reaktionsgeschwindigkeit für den SN2-Mechanismus.
Problem 3
Bleiben wir bei dem Allylhalogenid. Als Nebenprodukt der nucleophilen Substitution, egal ob sie nach dem einen oder dem anderen Mechanismus abläuft, findet sich folgende Verbindung:
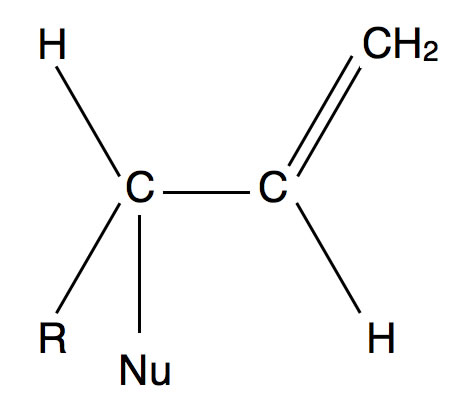
Ein Nebenprodukt der nucleophilen Substitution
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Das Nucleophil hat sich unerwarteterweise an das "falsche" C-Atom angelagert. Wie konnte es dazu kommen? Es gibt zwei Möglichkeit, dies zu erklären.
SN1-Mechanismus
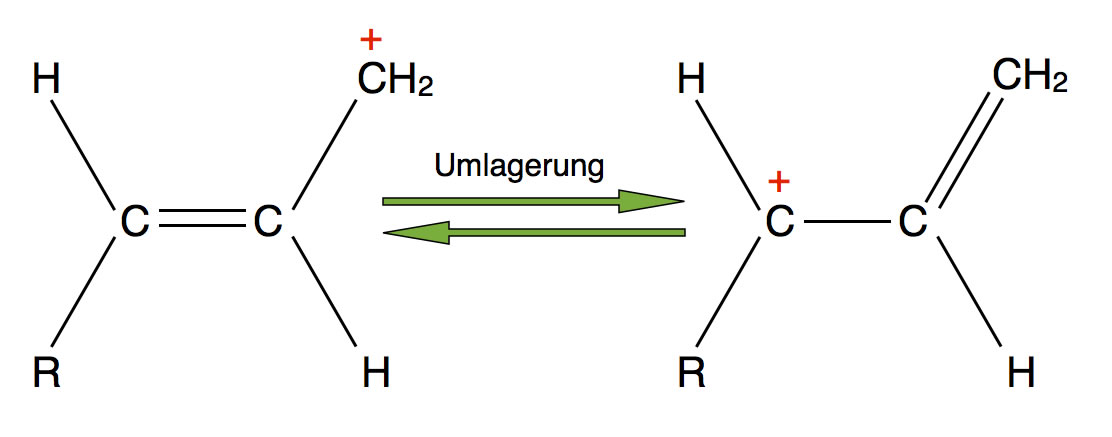
Carbenium-Ionen tendieren manchmal zu einer Umlagerung, wie im obigen Bild dargestellt. Die positive Ladung wird an dem linken C-Atom besser stabilisiert als an dem C-Atom rechts oben im Bild. Das liegt wieder an dem positiven induktiven Effekt, den Alkyl- und verwandte Gruppen ausüben. Das C-Atom links ist ein sekundäres, das C-Atom rechts oben nur ein primäres. Das Nucleophil kann sich nach dieser Umlagerung also an das "falsche" C-Atom setzen.
SN2-Mechanismus
Die Erklärung für das Nebenprodukt ist etwas schwieriger, wenn man den SN2-Mechanismus zu Grunde legt.
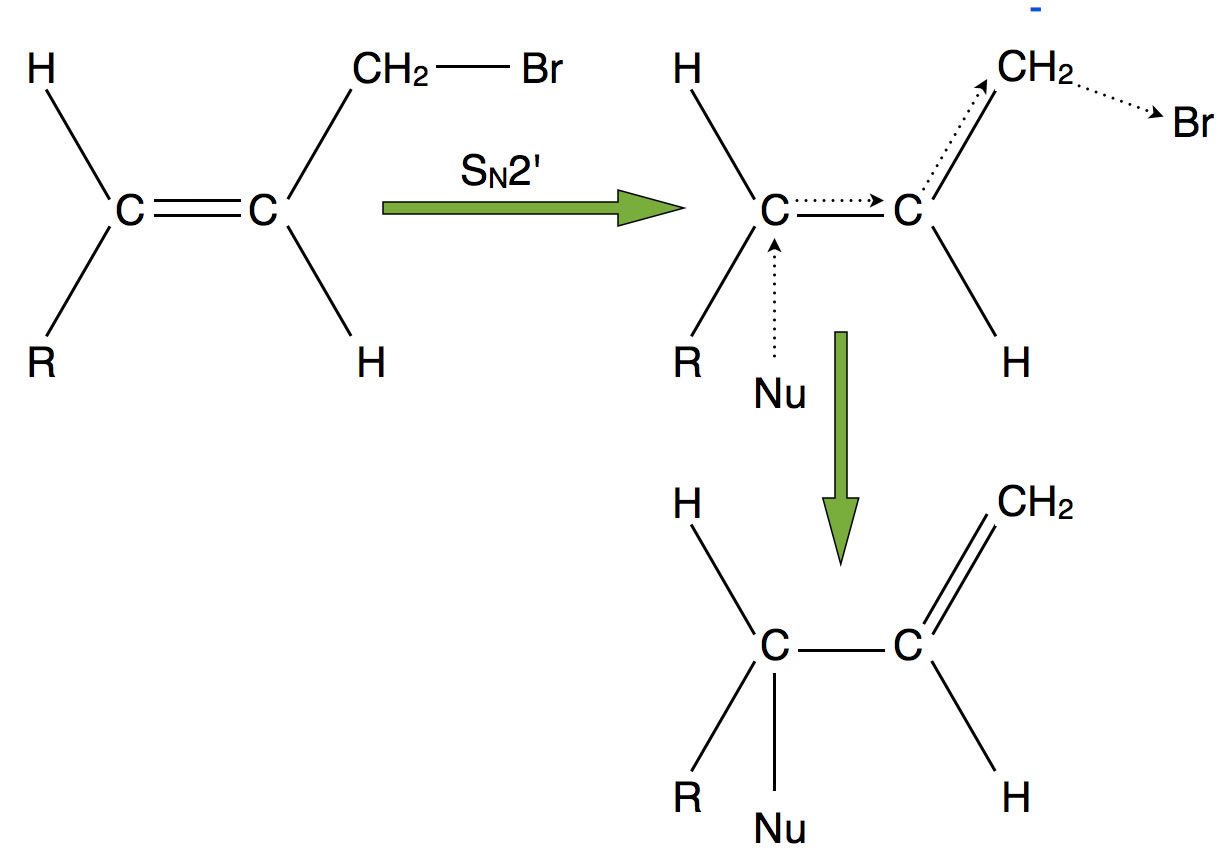
Bildung des Nebenproduktes während einer SN2-Reaktion
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Das Nucleophil kann in einer SN2-Reaktion nicht nur mit dem primären Halogen tragenden C-Atom reagieren, sondern auch mit dem einen C-Atom der C=C-Doppelbindung, wie im Bild dargestellt. Greift das Nucleophil dieses C-Atom an, dann "klappt" die Doppelbindung um, und die beiden Elektronen der neu hinzugekommenen Bindung verdrängen das Halogen-Atom.
Vergleich: SN2-Reaktion bei 3-Chlor-1-propen und 1-Chlorpropan
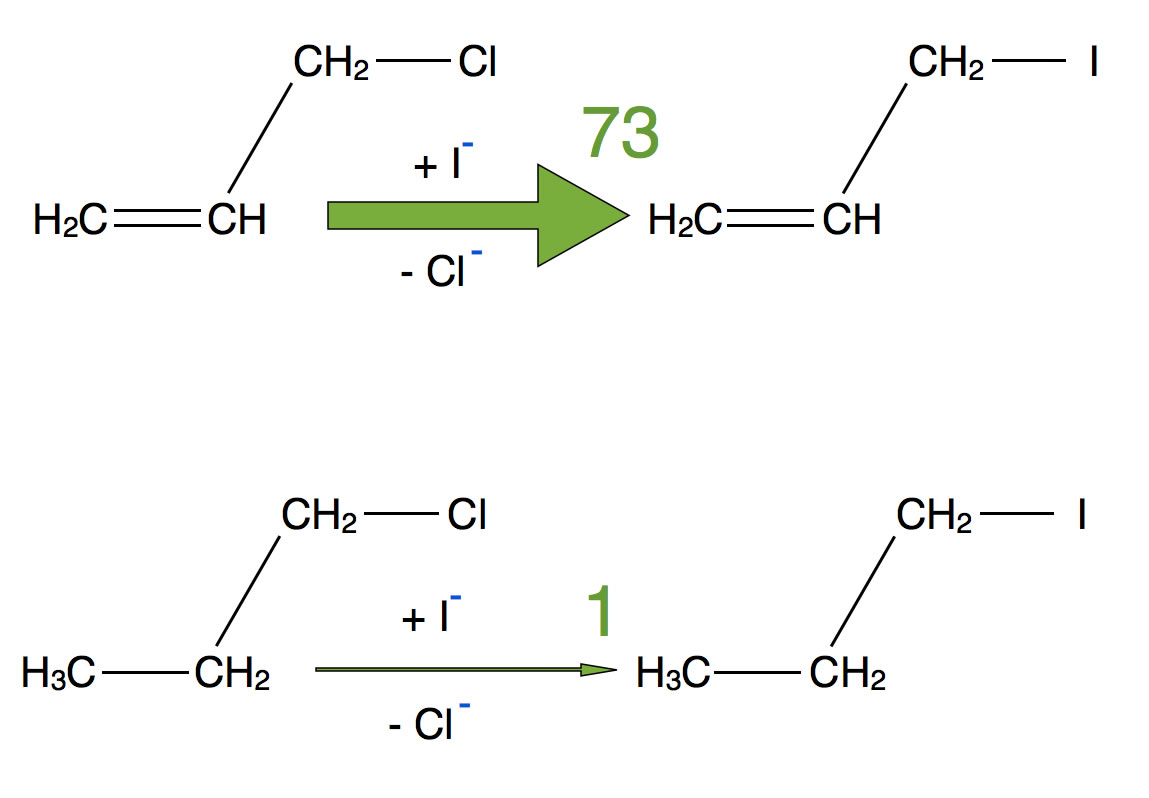
Reaktion von Chlorpropan und Chlorpropen mit Iodid
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
In dem Buch von Vollhardt und Schore (Organische Chemie, 5. Auflage) findet sich auf Seite 664 das oben gezeigte Beispiel. Setzt man die Reaktionsgeschwindigkeit der Reaktion des Chlor-Alkans auf den Wert 1, dann hat die Reaktionsgeschwindigkeit des Chlor-Alkens den Wert 73. Das Chlor-Alken reagiert also 73 mal so schnell mit Iodid-Ionen wie das Chlor-Alkan. Die Reaktion wurde übrigens in Aceton als Lösemittel und bei 50 ºC durchgeführt.
Trimethylphosphin reaktiver als Trimethylamin
Das Trimethylphosphin P(CH3)3, eine klare farblose Flüssigkeit mit stechendem Geruch, reagiert in Methanol als Lösemittel schneller als das analoge Trimethylamin N(CH3)3, ein farbloses brennbares, intensiv nach Fisch riechendes Gas. Diese Tatsache verwundert etwas, weil doch Trimethylamin eine stärkere Base ist als Trimethylphosphin. Sollte die stärkere Base nicht auch gleichzeitig das stärkere Nucleophil sein?
Die Lösung ist ganz einfach: Gerade weil das Trimethylamin eine stärkere Base ist, umgibt sich die Verbindung mit einer stärkeren Solvathülle aus Methanol-Molekülen. Dadurch wird die Nucleophilie dieser Verbindung stark behindert, denn die Solvathülle behindert die Reaktion des Nucleophils mit dem elektrophilen Zentrum des organischen Substrats.
Außerdem ist das Phosphin wegen der Größe des Phosphor-Atoms leichter polarisierbar, was ja auch die Nucleophilie erhöht.