Eliminierung als Konkurrenzreaktion zur SN1
Betrachten wir noch einmal den Versuch, der auf der Eingangsseite vorgestellt wurde. Das Halogenalkan 2-Brom-2-methyl-propan wurde mit Ethanol versetzt. In einer schön anzuschauenden Reaktion mit Bildung gelbweißer dicker Schlieren entsteht bei dieser Reaktion ein Ether, und die freigesetzten Bromid-Ionen reagieren mit dem zugesetzten Silbernitrat zu schwer löslichem Silberbromid. Dieses Salz verursacht dann die gelblichweißen Schlieren.
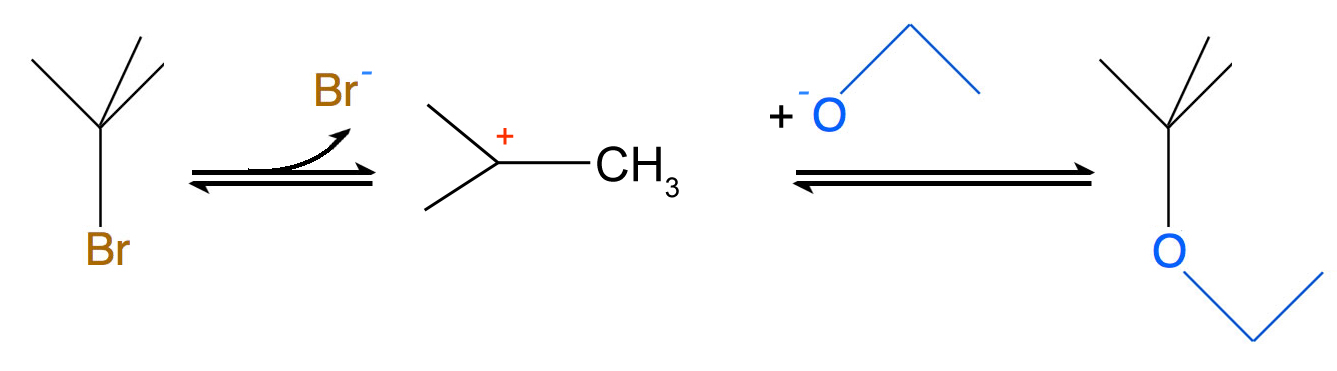
2-Brom-2methyl-propan + Ethanolat ---> Ethyl-butyl-ether + Bromid
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Diesen Versuch kann man sehr schön als Schülerversuch im Oberstufen-Chemieunterricht einsetzen. Das einzige Problem dabei ist, an das Edukt 2-Brom-2-methyl-propan heranzukommen.
Übrigens ist die Reaktion von Halogenalkanen mit Alkoholat-Anionen eine sehr wichtige organische Reaktion, die sogar einen eigenen Namen hat: Willamson-Ethersynthese oder auch Willamsonsche Ether-Synthese.
In der Schule haben wir nun leider nicht die Möglichkeit, die genaue quantitative Ausbeute an Substitutionsprodukt zu ermitteln. Ich verlasse mich da ganz auf die Ausführungen von Prof. Dyker in seiner Video-Vorlesung "Organische Chemie 1, Folge 22". Danach beträgt die Ausbeute ca. 80%; allerdings mit Methanol statt mit Ethanol[1].
Die Frage, die sich dann stellt, ist folgende: Was passiert mit den restlichen 20% des Eduktes?
An dieser Stelle wird es interessant. Wir könnten hier noch einmal auf den wichtigen Unterschied Nucleophil - Base eingehen. Das Alkohol-Molekül bzw. das Alkoholat-Ion reagiert in diesem Versuch zu 80% als Nucleophil. Das heißt, es greift das Carbenium-Ion des Substrats nucleophil an, das im ersten Reaktionsschritt der SN1 entsteht. Die drei Methylgruppen des Substrats sind nicht allzu groß und stellen keine sterische Hinderung dar, zumal die reaktive Zwischenstufe ja planar ist und daher gut von beiden Seiten angegriffen werden kann.
20% des Alkoholat-Ions reagieren aber als Base. Sie abstrahieren ein Proton aus dem Carbenium-Ion. Das Carbenium-Ion gibt als Brönsted-Säure ein Proton an die Brönsted-Base C2H5-O-: ab. Zurück bleibt ein Alken:
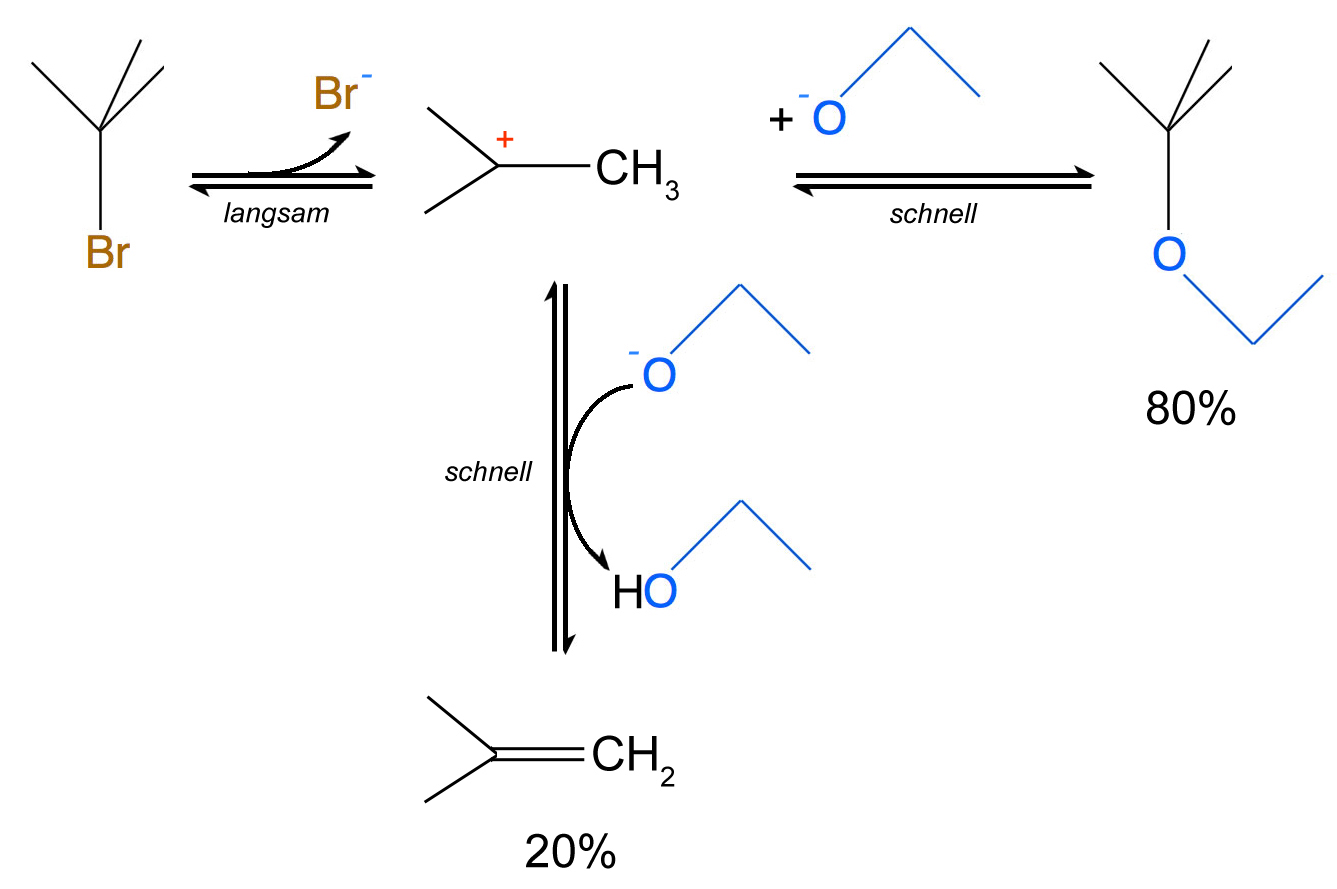
Die Nebenreaktion im zweiten Reagenzglas: 2-Brom-2methyl-propan + Ethanolat ---> 2-Methyl-propen + Ethanol + Bromid
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Wir haben es hier mit einem neuen Reaktionstyp zu tun, der Eliminierung.
Eliminierung = Reaktion, bei der zwei Teilchen (Atome, Ionen, Moleküle) aus einem organischen Molekül gleichzeitig oder kurz nacheinander abgespalten werden. Man unterscheidet alpha- und beta-Eliminierungen. Bei der alpha-Eliminierung befinden sich beide abgespaltenen Teilchen am gleichen C-Atom, bei der beta-Eliminierung an benachbarten C-Atomen. Bei der beta-Eliminierung können C=C-Doppelbindungen oder sogar Dreifachbindungen entstehen[2].
Eliminierungsreaktionen können auch nach ihrer Kinetik unterschieden werden. In unserem speziellen Fall handelt es sich um eine sogenannte E1-Eliminierung. Der erste Schritt der Eliminierung ist ja die Bildung des Carbenium-Ions, die bekanntlich eine Reaktion 1. Ordnung ist. Als langsamster Reaktionsschritt bestimmt diese Reaktion die Geschwindigkeit bzw. Kinetik der Gesamtreaktion, also läuft diese Eliminierung pseudomonomolekular mit einer Kinetik 1. Ordnung ab.
Die Eliminierungsreaktion tritt also in Konkurrenz zur SN1-Reaktion auf, die wiederum eine Konkurrenzreaktion zur SN2-Reaktion ist.
Quellen:
- Vorlesung von Prof. Dyker, "Organische Chemie 1, Folge 22"
- Römpp Chemie-Lexikon, 9. Auflage 1992