Experimentelle Untersuchungen der C=C-Doppelbindung haben gezeigt, dass die beiden Bindungen energetisch nicht gleichwertig sind. Die eine Bindung ist eine ganz normale kovalente Bindung, ist also recht stark, ähnlich wie eine C-C-Einfachbindung. Die andere Bindung ist aber wesentlich schwächer, die beiden Bindungselektronen sind hier deutlich schwächer gebunden. Das ist der Grund für das chemische Verhalten der C=C-Doppelbindung, die ja als "elektronenreich" gilt und von Nucleophilen "geliebt" wird.
Die starke C-C-Bindung wird als sigma-Bindung bezeichnet, die schwache C-C-Bindung als pi-Bindung. Mit dem Kugelwolkenmodell kann man das Zustandekommen dieser beiden unterschiedlichen Bindungen nicht erklären. Nach diesem Modell müssten beide Bindungen gleich stark sein, allerdings deutlich schwächer als eine C-C-Einfachbindung, da sich die Kugelwolken bei der Doppelbindung nicht mehr so stark überlappen wie bei der Einfachbindung.
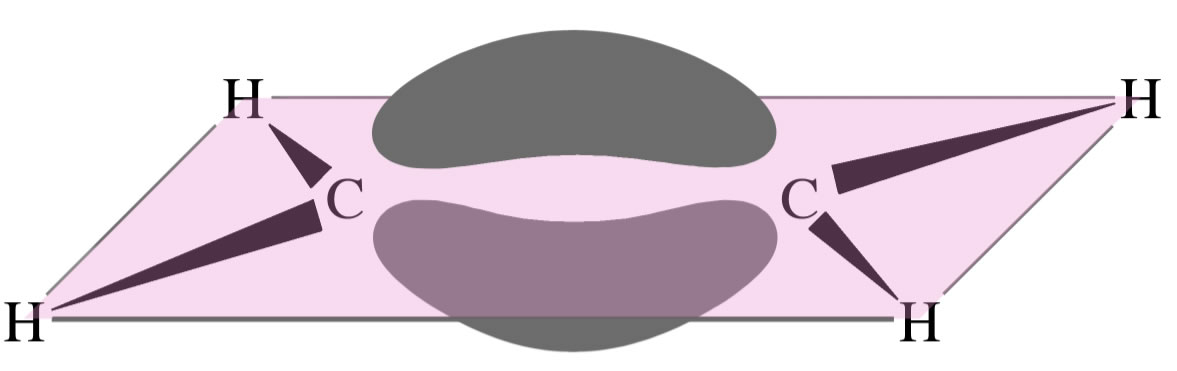
Das Ethen-Molekül mit "Bananenbindungen"
Hier sehen wir das Ethen-Molekül mit zwei kovalenten Bindungen, die sich gegenseitig abstoßen und daher wie zwei Bananen aussehen, man spricht hier in der Tat von einer "Bananenbindung".
Mit dem Orbitalmodell und sp3-hybridisierten C-Atomen kann man die C=C-Doppelbindung auch nicht besser erklären. Würde man hier ein Bild zeichnen, sähe dies genau so aus wie das Bild oben in der Kugelwolkenmodell-Darstellung, denn die sp3-Hybridorbitale haben fast die gleiche Gestalt wie die Kugelwolken des Kugelwolkenmodells.
sp2-Hybridisierung
Um die Existenz zweier verschiedener C-C-Bindungen in der C=C-Doppelbindung zu erklären, musste man das Konzept der Hybridisierung noch stärker verfeinern. Neben der sp3-Hybridisierung gibt es auch eine sp2-Hybridisierung und eine sp-Hybridisierung:
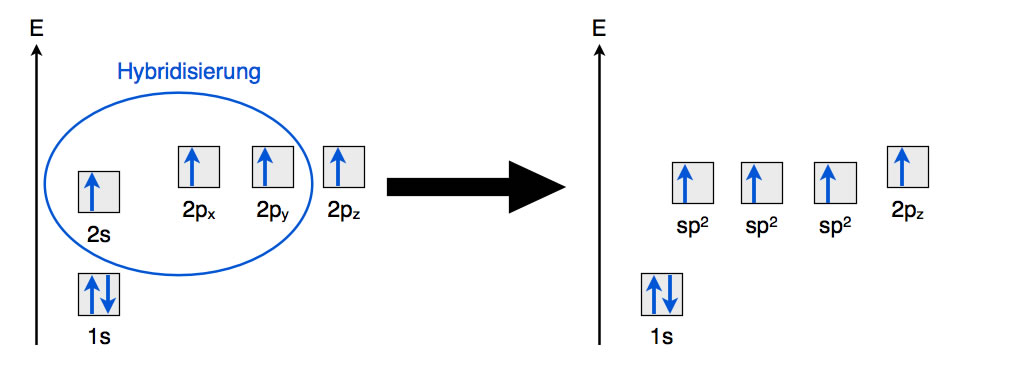
Die sp2-Hybridisierung im Energiediagramm
Bei der sp2-Hybridisierung wird das 2s-Orbital das Kohlenstoff-Atoms mit nur zwei 2p-Orbitalen "vermischt", es resultieren drei energetisch gleichwertige sp2-Hybridorbitale. Übrig bleibt ein unverändertes 2pz-Orbital.
Die sigma-Bindung
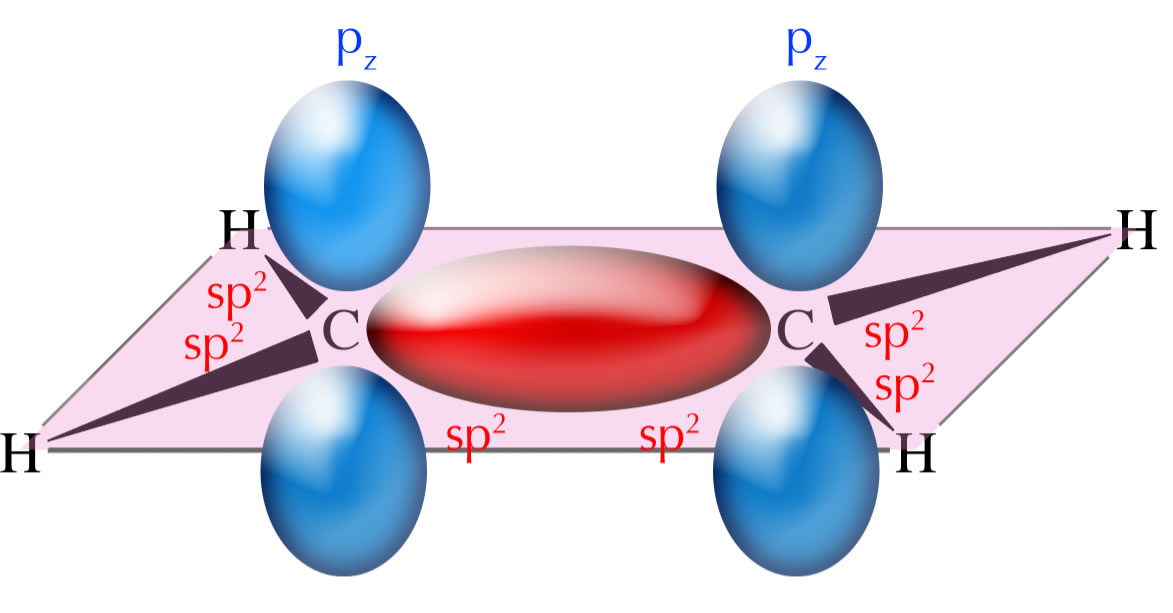
Die C=C-Doppelbindung: Die sigma-Bindung
In dieser Abbildung sehen wir das Ethen-Molekül mit seinen zwei sp2-hybridisierten C-Atomen. Die sp2-Hybridorbitale überlappen mit den 1s-Orbitalen der vier H-Atome. Die sigma-Bindung - im Bild rot gezeichnet - entsteht durch Überlappung von sp2-Hybridorbitalen der benachbarten C-Atome. Die pz-Orbitale - im Bild blau gezeichnet - stehen senkrecht aus der Ebene hervor. Jedes pz-Orbital besteht aus zwei Orbitallappen, je einer unterhalb der Ebene und oberhalb der Ebene.
Die pi-Bindung
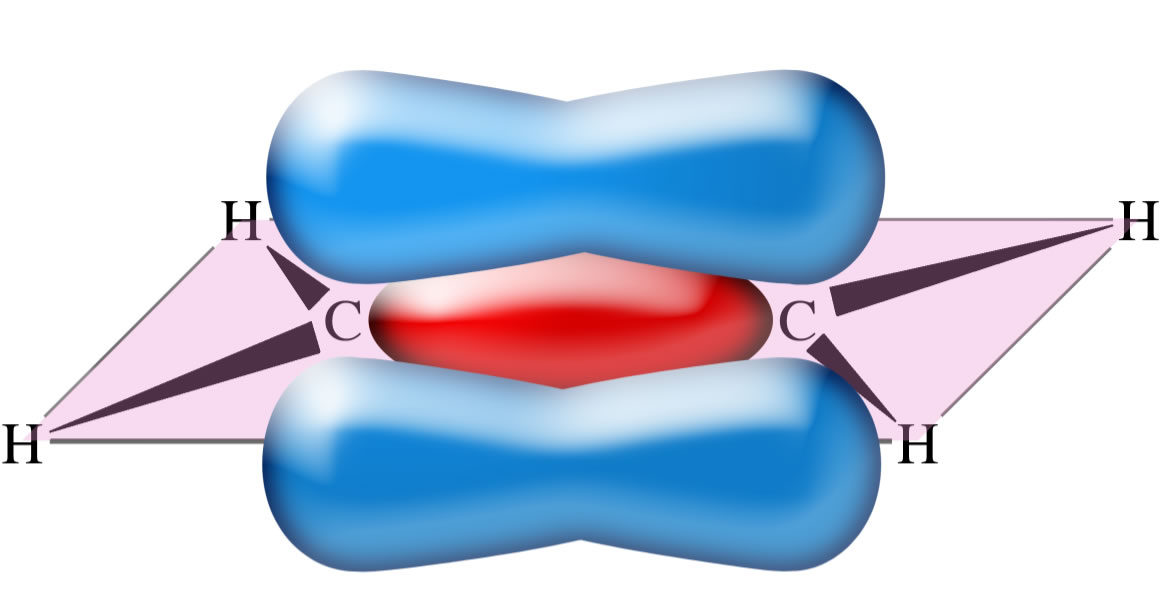
Die C=C-Doppelbindung: Die pi-Bindung
Die pi-Bindung entsteht nun durch eine schwache Überlappung der oberen und unteren Orbitallappen der beiden pz-Orbitale. Diese Überlappung ist recht schwach, daher ist auch die pi-Bindung sehr schwach und kann leicht gespalten werden, was das chemische Verhalten der Alkene gut erklärt.