Die NRW-Abituraufgabe für den Leistungskurs Chemie erschien 2014. In dieser Aufgabe zu Kupferoxid-Zink-Batterien geht es vor allem um galvanische Elemente, Redoxreaktionen, Redoxpotenziale, die NERNST-Gleichung und um den Einfluss des pH-Wertes auf das Redoxpotenzial.
Teilaufgabe 1
a) Die Schüler sollen in der ersten Teilaufgabe eine galvanische Zelle zeichnen, die der Beschreibung einer historischen Kupferoxid-Zink-Batterie im beigefügten Text entspricht.
b)
Die Zeichnung soll beschriftet sein, und die am den Elektroden ablaufenden Reaktionen sollen aufgeschrieben werden.
c)
Schließlich soll die Spannung berechnet werden, die unter Standardbedingungen herrscht.
Lösung a) ist trivial
Lösung b)
Die Komplikation bei den Elektrodenreaktion ist das stark alkalische Medium des Elektrolyten mit einer hohen Hydroxidionen-Konzentration. An der Zink-Elektrode läuft daher nicht die einfache und bekannte Reaktion
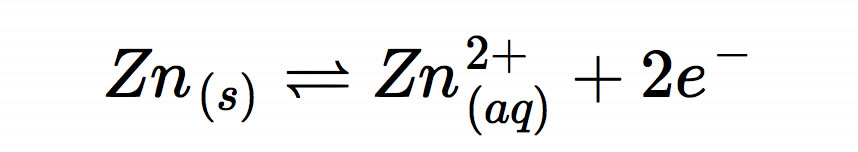
ab, sondern die etwas komplexere Reaktion:
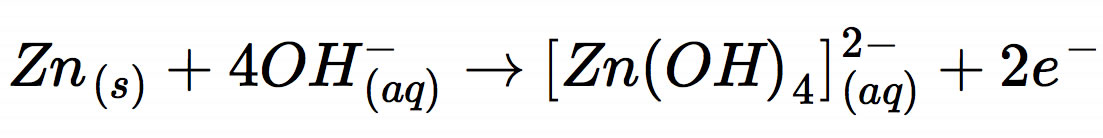
Ursache für den etwas komplexeren Ablauf ist die hohe Hydroxidionen-Konzentration.
Auch die Reaktion am Pluspol ist etwas ungewohnt. Hier findet nicht die übliche Reaktion
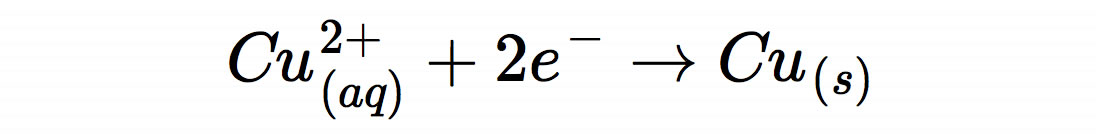
statt, sondern die Reaktion
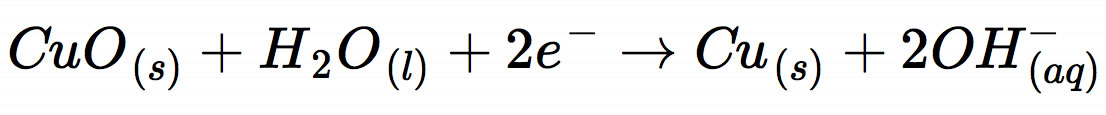
Der Grund hierfür ist die Bauweise der Zink-Kupferoxid-Batterie. Statt normaler Kupferelektroden verwendet man hier gepresste Platten aus schwarzem Kupferoxid CuO, das man irgendwie elektrisch leitfähig gemacht hat.
Lösung c)
Die Spannung, welche diese Batterie liefert, kann mit Hilfe der beigefügten Tabelle von Standardredoxpotenzialen berechnet werden, wenn man weiß, wo man hinschauen muss:
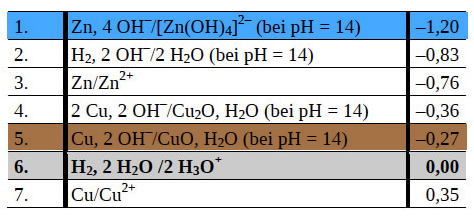
Den Schülern sollte es hier nicht schwer fallen, die erste und die fünfte Zeile zu wählen und dann eine Spannung von 0,93 Volt zu berechnen.
Teilaufgabe 2
Aspekt 1
Zunächst soll erläutert werden, wieso in einer verbrauchten CuO-Zn-Batterie nur noch ein Rest der Zinkplatte vorhanden ist.
Lösung 1
Die Antwort auf diese Frage ist recht einfach: Das Zink wird während der Entladung der Batterie verbraucht, die Zink-Ionen reagieren mit den Hydroxid-Ionen zu dem [Zn(OH)4]2--Komplex.
Aspekt 2
Im beigefügten Text wird dann beschrieben, wie ein Techniker den Zustand einer solchen Batterie prüfen kann: Mit einem spitzen Gegenstand sticht man in die CuO-Platte hinein, und je mehr metallisches Kupfer zu sehen ist, desto verbrauchter ist die Batterie. Die S. sollen das Verfahren erklären.
Lösung 2
Die Lösung ist hier ebenfalls nicht allzu schwer. Beim Entladen reagiert das Kupferoxid zu Kupfer:
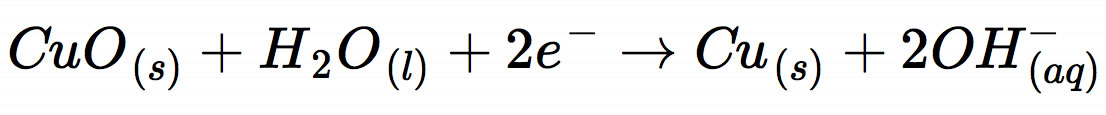
und je mehr Kupfer bei der Untersuchung zu erkennen ist, desto mehr ist die Batterie entladen.
Aspekt 3
Nun kommt die "Hammeraufgabe" - zumindest für Grundkursschüler nicht ganz einfach - aber dies ist ja auch eine Leistungskurs-Aufgabe. Die Schüler sollen berechnen, welche Masse an Zink benötigt wird, wenn die Batterie eine Kapazität von 40 Ah haben soll.
Lösung 3
Um diese Aufgabe lösen zu können, müssen die Schüler zunächst einmal den Zusammenhang zwischen Stoffmenge und Ladung kennen:
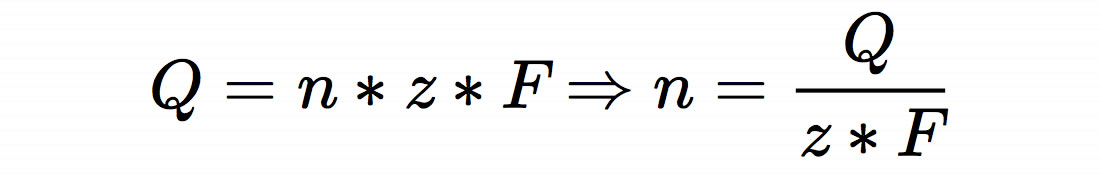
Dabei ist n die zu berechnende Stoffmenge in mol, Q ist die angegebene Kapazität, nämlich 40 * 3600 As (von Ah hochgerechnet), z ist die Ladung der Zink-Ionen, nämlich 2, und F ist die FARADAY-Konstante, nämlich 96.485 As/mol (im Material vorgegeben).
Setzt man diese Daten in obige Gleichung ein, so erhält man
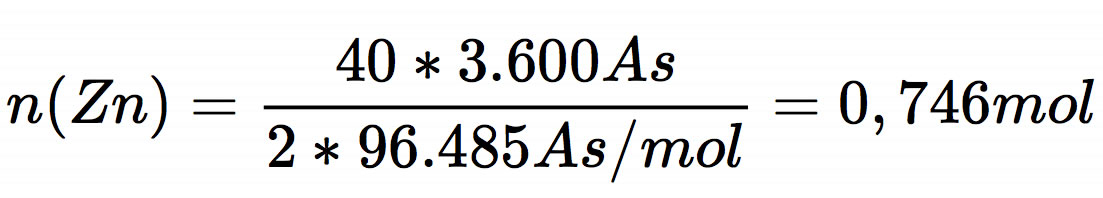
Jetzt hat man die erforderliche Stoffmenge n(Zn), aus der man leicht die benötigte Elektrodenmasse berechnen kann:
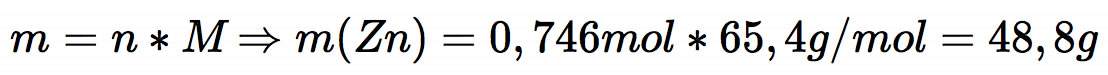
Puh, das war ja nicht ganz einfach!
Teilaufgabe 3
Aspekt 1
Hier können sich die Schüler wieder mal etwas entspannen. Sie sollen den Einsatz von Kupfer(I)-oxid und Kupfer(II)-oxid in einer Kupferoxid-Zink-Batterie vergleichen.
Lösung 1
Mit Cu2O ergibt sich bei pH = 14 eine nicht so große Spannung wie mit CuO.

Das kann man recht schnell der obigen (beigefügten) Tabelle entnehmen, wenn man die Zeilen 4 und 5 vergleicht.
Da beide Kupferoxide unter alkalischen Bedingungen schlecht wasserlöslich sind, sind auch beide Kupferoxide als Plattenmaterial geeignet, Kupfer(II)-oxid liefert aber eine geringfügig höhere Spannung und ist daher sinnvoller.
Aspekt 2
Es soll geprüft werden, ob man eine solche Batterie wieder aufladen kann.
Lösung 2
Der Entladungsvorgang wäre nur dann reversibel, wenn man Zink-Ionen wieder zu Zink-Atomen reduzieren könnte - was ja theoretisch möglich wäre.
Bei einem Zink-Kupfer(II)-oxid-Akkumulator gäbe es jedoch ein Problem, das die Schüler nur dann erkennen, wenn sie im Unterricht beim Thema Zersetzungspannung gut aufgepasst haben.
Das Aufladen eines Zink-Kupfer(II)-oxid-Akkus erfordert eine Spannung von mindestens 0,84 Volt (Differenz zwischen -0,36 V und -1,20 V); beim Aufladen eines Zink-Kupfer(I)-oxid-Akkus ist die erforderliche Spannung noch etwas höher.
Sobald die Zersetzungsspannung des Wassers erreicht ist - U = 1,3 - beginnt die Elektrolyse des Wassers mit einer unerwünschten Gasproduktion (Wasserstoff und Sauerstoff). Dies muss unbedingt vermieden werden.
Fazit: Eine moderne Zink-Kupferoxid-Batterie kann (vorsichtig) wieder aufgeladen werden.
In den sehr schönen gemachten "Prüfungsaufgaben mit Lösungen" des Stark-Verlags wird darauf hingewiesen, dass beim Aufladen einer solchen Batterie Zink-Bäumchen aus der Zink-Elektrode herauswachsen könnten, die dann irgendwann die Kupferoxid-Elektrode berühren und zu einem Kurzschluss führen könnten.
Teilaufgabe 4
Hier sollen die Schüler Modellexperimente zu einem Volta-Element erläutern, die in den fachspezifischen Vorgaben dargestellt sind.
In diesen Modellexperimenten wurde ein Volta-Element aus Kupfer- und Zinkblechen gebaut, deren Oberflächen leicht oxidiert waren. Die Bleche tauchten in Schwefelsäure der Konzentration 0,5 mol/l ein.
Beobachtung 1
a) Nach einiger Zeit war das Kupferblech frei von Oxiden, und die Elektrolyt-Lösung färbte sich blau.
b)
Schaltete man dann einen Verbraucher in den Stromkreis, so wurde die Lösung wieder farblos.
Erklärung 1
a) Die Kupferoxide reagierten mit der Schwefelsäure zu Kupfersulfat, das nun mal blau ist, wie jeder weiß. Daher wurden die Kupferbleche blank, und die Schwefelsäure blau.
b) Beim Entladen des Volta-Elements setzt die Zink-Elektrode Elektronen frei, die durch den Verbraucher zur Kupfer-Elektrode fließen und dort die gelösten Kupfer-Ionen zu metallischem Kupfer reduzieren. Die Blaufärbung der Lösung verringerte sich deshalb.
Beobachtung 2
a) Nach dem Verschwinden der Blaufärbung bildeten sich an der Kupferelektrode Gasbläschen,
b)
dabei verringerte sich auch die Spannung des Volta-Elementes.
Erklärung 2
a) Wenn in der Lösung keine Kupfer-Ionen mehr vorhanden sind, müssen die Elektronen, die von der Zink-Elektrode geliefert werden, ja irgendwo hin. Wegen der Anwesenheit der Schwefelsäure sind aber jede Menge Oxonium-Ionen in der Lösung vorhanden, die Elektronen aufnehmen können und dann zu gasförmigem Wasserstoff werden.
b) um diese Beobachtung zu erklären, muss man sich wieder die Tabelle mit den Redoxpotenzialen anschauen:

Hier sind die Zeilen 6 und 7 interessant. In der leicht sauren Lösung (Konzentration der Schwefelsäure ist nur 0,5 mol/l) gilt für die Kupfer-Elektrode die Zeile 7, solange noch genügend Kupfer-Ionen in der Lösung vorhanden sind. Sind diese aber aufgebraucht, kommt es zur Wasserstoff-Entwicklung, und dann ist aus der Kupfer-Elektrode plötzlich eine Wasserstoff-Elektrode geworden. Hierfür gilt die Zeile 6. Das Standardredoxpotenzial der Wasserstoff-Halbzelle ist aber um 0,35 Volt "kleiner" als das der Kupfer-Halbzelle, daher ist auch die gemessene Spannung um 0,35 Volt geringer.
Beobachtung 3
a) Beim Entladen des Volta-Elementes stieg der pH-Wert der Elektrolyt-Lösung etwas an.
b) Die Masse des Zinkblechs nimmt während des Entladens deutlich ab, die Masse des Kupferblechs so gut wie gar nicht.
Erklärung 3
a) Der Anstieg des pH-Wertes ergibt sich aus der Reduktion der Oxonium-Ionen, die bereits bei Erklärung 2a) erläutert wurde.
b) Das Zink wird oxidiert und in Zink-Ionen umgewandelt, sie sich in der Schwefelsäure lösen. Das Kupfer dagegen wird von der Säure nicht angegriffen, und die Kupfer-Ionen der Lösung werden reduziert, so dass sogar noch mehr Kupfer entsteht. Wenn die Masse der Kupfer-Elektrode leicht zurückgeht, so liegt das an der Oxidschicht, die sich auf der Elektrode gebildet hat. Während der Reaktion wird aus dem Kupferoxid reines Kupfer, das eine geringere molare Masse hat als das Kupferoxid.