Wir wollen den pH-Wert einer 0,01-molaren Lösung von Schwefelwasserstoff berechnen. Schwefelwasserstoff H2S ist eine schwache Säure mit einem pKS-Wert von 6,92.
Zunächst stellen wir die Protolysegleichung auf:
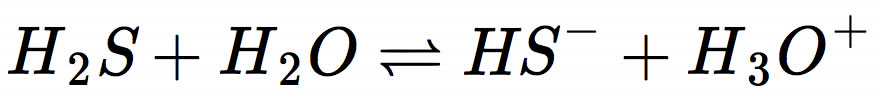
Dann wenden wir das Massenwirkungsgesetz an und stellen die Formel für den KS-Wert auf:
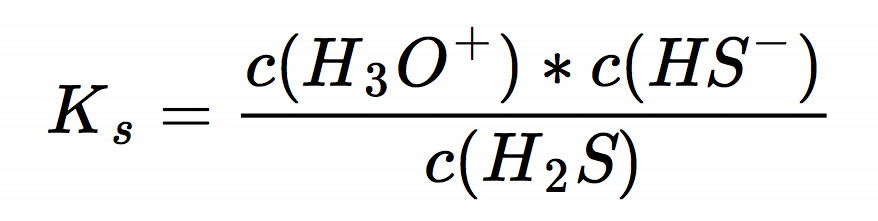
Da eine Säure zu gleichen Teilen in Protonen und Säurerest-Ionen zerfällt, kann man noch etwas vereinfachen:
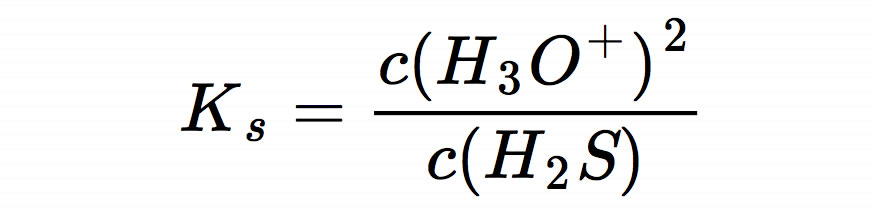
Da wir uns zum Ziel gesetzt haben, den pH-Wert der sauren Lösung zu berechnen, müssen wir die Gleichung nach c(H3O+) umstellen:
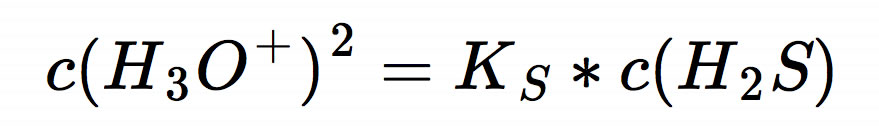
Jetzt müssen wir auf beiden Seiten der Gleichung die Quadratwurzel ziehen, und schon haben wir praktisch den pH-Wert:
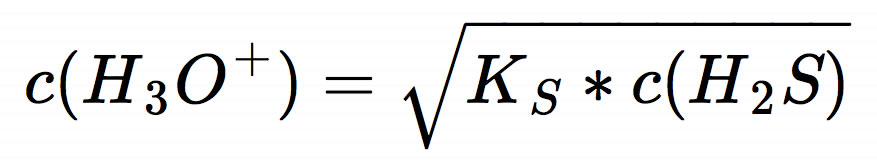
Das ist die allgemeine Gleichung zur Berechnung des pH-Wertes einer schwachen Säure. Um den pH-Wert unserer 0,01-molaren Schwefelwasserstoff-Lösung zu berechnen, müssen wir jetzt die konkreten Werte einsetzen.
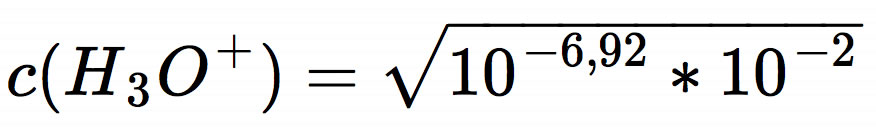
Den pH-Wert kann man jetzt im Kopf ausrechnen. Unter der Wurzel steht 10-8,92, und die Wurzel eines solchen Ausdrucks berechnet man, indem man den Exponenten halbiert. So kommen wir auf
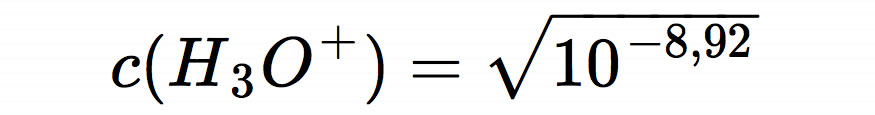
und weiter zu
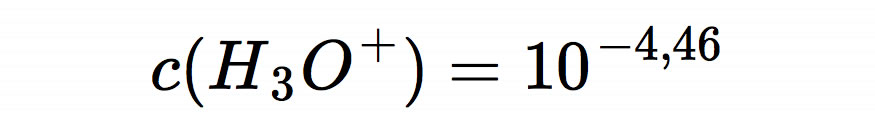
Damit wären wir fertig mit der Berechnung. Der pH-Wert unserer sauren Lösung beträgt 4,46.
Bei einer schwachen Säure erhält man die Oxoniumionen-Konzentration aus der Quadratwurzel des mit der Anfangskonzentration c0(HA) der Säure multiplizierten KS-Wertes:
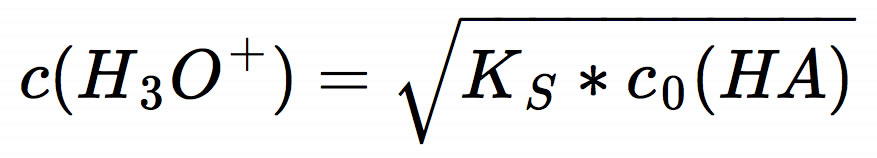
Für c0(HA) = 1 mol/l gilt die Vereinfachung, dass c(H3O+) der Wurzel des KS-Wertes entspricht. Oder noch einfacher: pH = 1/2 pKS. Aber, wie gesagt, das gilt nur für 1-molare Lösungen einer schwachen Säure.