In den meisten Schulbüchern wird Trypsin als ein Verdauungsenzym für Proteine dargestellt, das im Dünndarm im leicht alkalischen Milieu arbeitet.
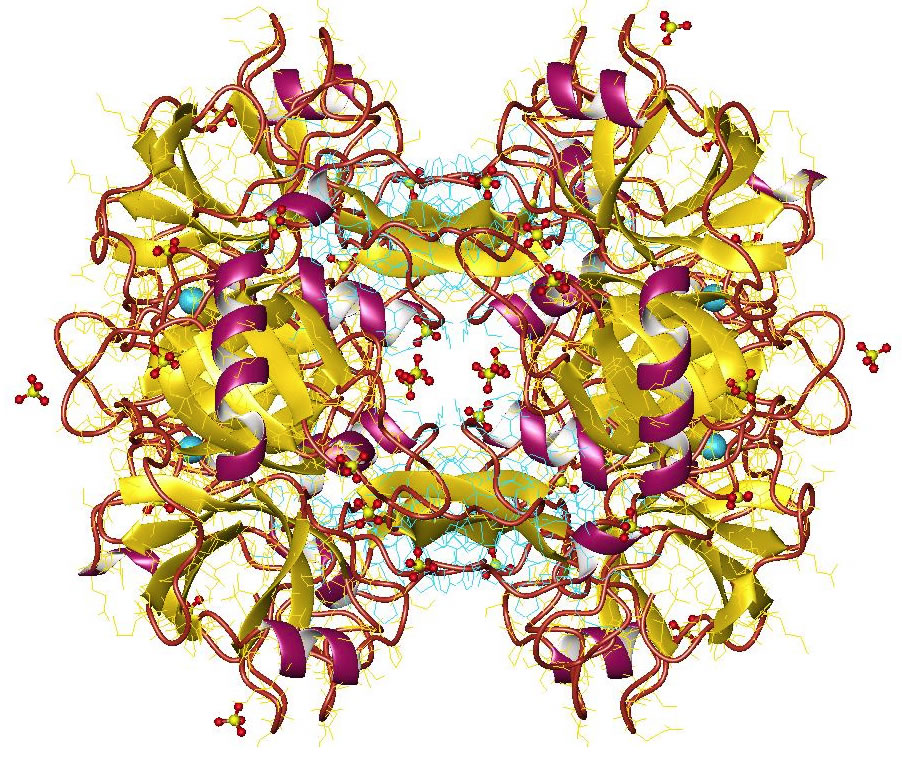
Ein Trypsin-1-Molekül
Quelle: Wikipedia, Artikel "Trypsin", Deposition authors: Salameh, M.A., Soares, A.S., Radisky, E.S.;, visualization author: User:Astrojan
Lizenz: Creative Commons Attribution 4.0 International license.
In Wirklichkeit gibt es beim Menschen drei Trypsine, nämlich Trypsin-1, Trypsin-2 und - wer hätte es gedacht - Trypsin-3.
Die Abbildung 1 zeigt das Trypsin-1, das aus 224 Aminosäuren besteht. Trypsin-1 ist das wichtigste Trypsin des Menschen, es macht ca. 66% des Gesamttrypsins aus (Trypsin-2 ca. 30%, Trypsin-3 nur wenige Prozent) [1].
Hat der Mensch zu wenig Trypsin, kann das zu einer Unterernährung durch Proteinmangel führen. Selbst wenn die Nahrung eine mehr als ausreichende Menge an Eiweiß enthält, kann dieses nicht verdaut werden, es werden keine Aminosäuren gebildet, die dann ins Blut gelangen.
Wirkungsweise
Die Trypsine gehören zu den Endopeptidasen. Das heißt, sie hydrolysieren Peptidbindungen, die sich im Innern eines Peptids befinden - im Gegensatz zu Exopeptidasen, die ein Peptid "von außen" zerlegen, also Peptidbindungen spalten, die sich am N-Terminus oder C-Terminus des Peptids befinden.
Endopeptidasen spalten nicht wahllos irgendwelche Peptidbindungen, sondern greifen die Peptidbindungen zwischen bestimmten Aminosäuren spezifisch an. Trypsine spalten Peptidbindungen, die von den Aminosäuren Lysin oder Arginin gebildet werden. Die Hydrolyse findet carboxyseitig statt [2], also "hinter" der jeweiligen Aminosäure.
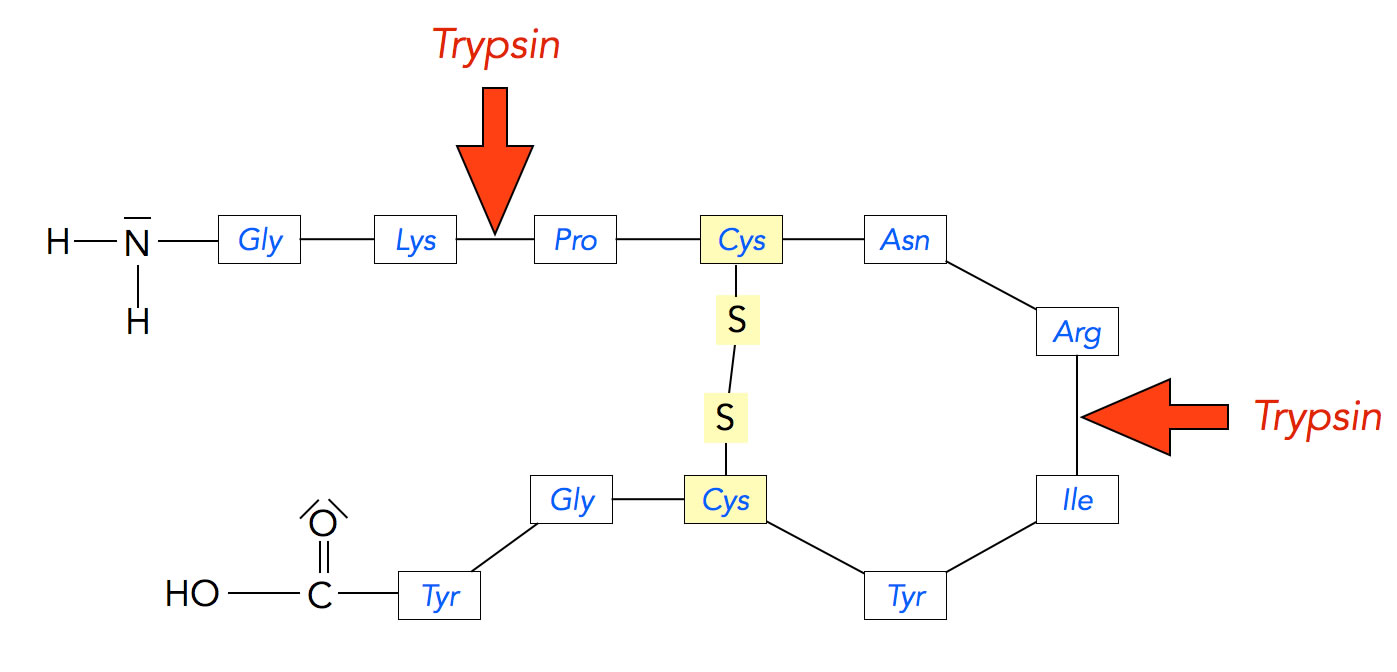
Die Angriffsstellen von Trypsin
Autor: Ulrich Helmich, Lizenz: Public domain
Quellen:
- Wikipedia, Artikel "Trypsine"
- Römpp Chemie-Lexikon, 9. Auflage 1992