Auf dieser Seite wird vor allem der biologische Schwefelkreislauf besprochen. Alle Lebewesen sind aus Proteinen aufgebaut, und Proteine enthalten die Aminosäuren Cystein und Methionin. Beides sind schwefelhaltige Aminosäuren.
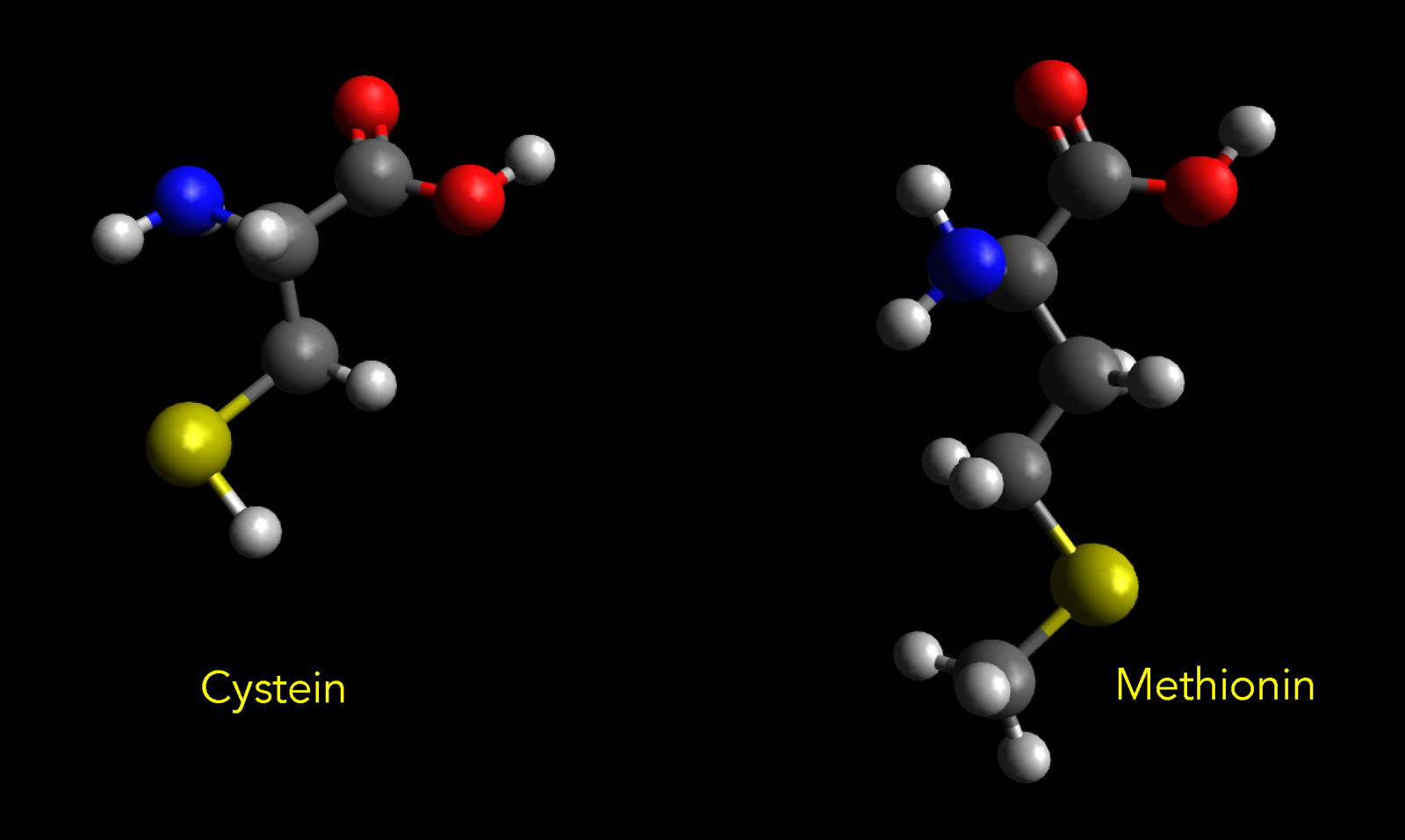
Die schwefelhaltigen Aminosäuren Cystein und Methionin
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Einige andere Verbindungen (Enzyme, Coenzyme etc.) wie zum Beispiel Biotin enthalten ebenfalls Schwefel. Viele Eisen-Schwefel-Proteine spielen bei Redoxreaktionen, zum Beispiel in der Atmungskette, eine wichtige Rolle. Ein menschlicher Körper enthält im Schnitt 140 g Schwefel, das ist recht viel [3].
Wie gelangt der Schwefel überhaupt in solche biologisch wichtigen Verbindungen? Der komplexe biochemische Prozess des Schwefel-Einbaus heißt Sulfat-Assimilation (in Anlehnung an die Kohlenstoff-Assimilation, auch als Photosynthese bekannt). Letzten Endes also benötigen die Lebewesen Sulfat-Ionen, damit sie solche Moleküle aufbauen können.
Der umgekehrte Prozess findet statt, wenn Lebewesen sterben und verrotten. Bei der Fäulnis werden die schwefelhaltigen organischen Verbindungen stufenweise abgebaut, bis schließlich nur noch Schwefelwasserstoff H2S übrig ist - ein Molekül, das ähnlich aufgebaut ist wie Wasser H2O, nur statt Sauerstoff haben wir hier ein Schwefelatom.
Schauen wir uns einmal den Schwefelkreislauf genauer an:
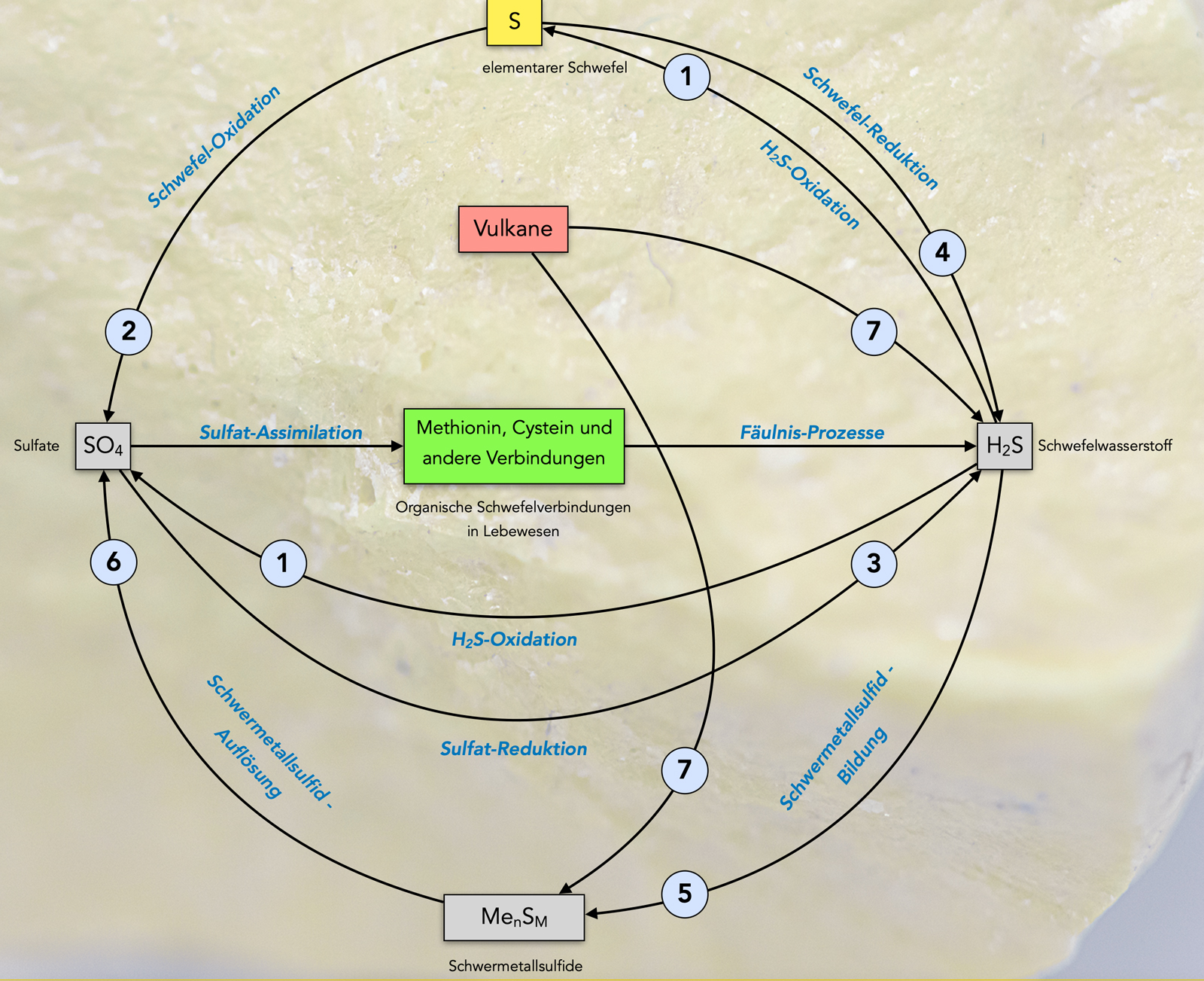
Der biologische Schwefelkreislauf
Autor: Ulrich Helmich 2022, Lizenz: Public domain. Zum Vergrößern bitte klicken.
Die beiden eben genannten grundlegenden Prozesse, Sulfat-Assimilation und Fäulnis, finden Sie in der Mitte des Bildes. Am Fäulnis-Prozess sind viele Mikroorganismen beteiligt, vor allem Bakterien. Bakterien und Archaeen sind aber auch in der Lage, einige andere Reaktionen durchzuführen, die für den Schwefelkreislauf wichtig sind.
1. H2S-Oxidation
Vom H2S zum S oder SO42-
Bestimmte Prokaryoten sind in der Lage, aus Schwefelwasserstoff elementaren Schwefel zu gewinnen. Chemisch gesehen ist das eine Oxidation, da Wasserstoff entfernt wird.
Das machen die Prokaryoten natürlich nicht, weil sie sich an der schönen gelben Farbe des Schwefels erfreuen, sondern weil sie bei der Reaktion chemische Energie gewinnen (die meisten Oxidationen sind exotherm) sowie Kohlenhydrate aufbauen können, aus denen sie ebenfalls Energie gewinnen können.
In den Meeren unseres Planeten gibt es sogenannte Raucher (schwarze und weiße). Das sind Quellen am Grund der Tiefsee, aus denen sehr heißes Wasser austritt (bis zu 300 ºC), das neben anderen Stoffen auch Schwefelwasserstoff enthält. An diesen Rauchern hat sich eine vielfältige Lebensgemeinschaft gebildet, in der auch Prokaryoten (vor allem Archaeen) vorkommen, die Schwefelwasserstoff als Energiequelle nutzen. Dabei läuft folgende chemische Reaktion ab [1]:
$6 \ CO_{2} + 24 \ H_{2}S +6 \ O_{2} \to C_{6}H_{12}O_{6} + 24 \ S + 18 \ H_{2}O$
Bei den grünen Schwefelbakterien ist die Reaktion etwas abgewandelt [2]:
$6 \ CO_{2} + 12 \ H_{2}S \to C_{6}H_{12}O_{6} + 12 \ S + 6 \ H_{2}O$
Vergleichen wir das einmal mit der Kohlenstoff-Assimilation der grünen Pflanzen:
$6 \ CO_{2} + 12 \ H_{2}O \to C_{6}H_{12}O_{6} + 6 \ O_{2} + 6 \ H_{2}O$
Man sieht hier durchaus eine gewisse Analogie.
Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
Andere Prokaryoten führen die folgende Reaktion durch, bei der dann Sulfat entsteht [2]:
$6 \ CO_{2} + 6 \ H_{2}S + 6 \ O_{2} + 6 \ H_{2}O \to C_{6}H_{12}O_{6} + 6 \ SO_{4}^{2-} + 12 \ H^{+}$
Auch das ist eine Oxidation, weil der Schwefel jetzt Sauerstoff aufnimmt.
Thiobacillus und andere Prokaryoten können ebenfalls Schwefelwasserstoff zu Sulfat oxidieren, allerdings mit einer viel einfacheren Reaktion [4]:
$H_{2}S + 2 \ O_{2} \to H_{2}SO_{4}$
2. Schwefel-Oxidation
Einige aerobe Bakterien und Archaeen sind in der Lage, elementaren Schwefel mit Hilfe von Sauerstoff in Sulfat umzuwandeln:
$2 \ S + 2 \ H_{2}O + 3 \ O_{2} \to 2 \ H_{2}SO_{4}$
Dies ist eine der vielen chemischen Reaktionen, die zum Beispiel von der Bakterien-Gattung Thiobacillus durchgeführt wird [4].
Sulfate
Sulfate sind die Hauptspeicherform von Schwefel auf der Erde. Sowohl in den Sedimenten der Tiefsee wie auch in Gesteinen an Land ist Schwefel in Form von Sulfaten gebunden. Calciumsulfat (Gips) ist hier nur ein Beispiel.
Pflanzen können die Sulfate über die Wurzeln aufnehmen und in organische Verbindungen umwandeln. Vorher müssen sie die SO42--Ionen (Oxidationsstufe +VI) allerdings reduzieren, und zwar zu Sulfid S2- (Oxidationsstujfe -II). Die Reduktion findet in den Chloroplasten statt, und als Reduktionsmittel werden verschiedene in der Photosynthese hergestellte Reduktionsmittel wie Glutathion oder Ferredoxin eingesetzt [7].
Tiere können keine Sulfat direkt verwerten, sie müssen ihren Schwefelbedarf über pflanzliche oder tierische Nahrung decken.
3. Sulfat-Reduktion
Manche Bakterien und Archaeen können Sulfate direkt in Schwefelwasserstoff oder Sulfide (Salze des Schwefelwasserstoffs) umwandeln. Chemisch gesehen ist das eine Reduktion, denn es wird Sauerstoff abgegeben und Wasserstoff aufgenommen. Am einfachsten erfolgt die Sulfat-Reduktion direkt mit Wasserstoff [5]:
$SO_{4}^{2-} + 4 \ H_{2} \to HS^{-} + 3 \ H_{2}O + OH^{-}$
Bei dieser Reaktion werden 112 kJ/mol Energie freigesetzt (freie Energie ΔG). Steht kein elementarer Wasserstoff zur Verfügung, können auch wasserstoffreiche organische Verbindungen als Reduktionsmittel dienen, zum Beispiel Lactat oder Acetat.
$SO_{4}^{2-} + 2 \ Lactat \to HS^{-} + 2 \ Acetat + CO_{2} + HCO_{3}^{-} + H_{2}O$
Hier werden sogar 157 kJ/mol frei, die Reaktion ist also sehr exergonisch.
4. Schwefel-Reduktion
Manche anaeroben Bakterien oder Archaeen können auch elementaren Schwefel reduzieren, mit Wasserstoff oder wasserstoffreichen organischen Verbindungen.
$S + RH_{2} \to H_{2}S + R$
Hierbei ist R der Rest einer organischen Verbindung wie Lactat.
5. Schwermetallsulfid-Bildung
Durch die Reaktion von Schwefelwasserstoff mit Schwermetall-Ionen (vor allem Fe2+) wird der giftige Schwefelwasserstoff unschädlich gemacht. Die Schwermetallsulfide sind in der Regel extrem wasserunlöslich und stellen daher keine Gefahr mehr für die Lebewesen dar.
6. Schwermetallsulfid-Auflösung
Schwermetallsulfide können aber auch wieder zur Energiegewinnung dienen. Einige Bakterien und Archaeen können diese Sulfide oxidieren, wobei Sulfate entstehen. Die Oxidation der Sulfid-Ionen liefert den Prokaryoten Energie.
7. Vulkanismus
Durch aktive Vulkane gelangt Schwefelwasserstoff in die Atmosphäre und in das Wasser, auch Schwermetallsulfide werden von Vulkanen an die Biosphäre abgegeben. Ca. 10 bis 20% des atmosphärischen Schwefels gelangen durch Vulkanausbrüche in die Luft [6].
Neuere Erkenntnisse zum biologischen Schwefelkreislauf
Die Abbildung 1 zeigt den Schwefelkreislauf, wie er in vielen älteren Schul- und Fachbüchern sowie in der Wikipedia (Stand 9/2022) beschrieben wird. Neuere Erkenntnisse zeigen jedoch, dass im Meer viele organische Schwefelverbindungen nicht in Form von H2S freigesetzt werden, sondern als Dimethylsulfid (DMS). Man schätzt, dass im Jahr ca. 300 Millionen Tonnen DMS im Meer entstehen.
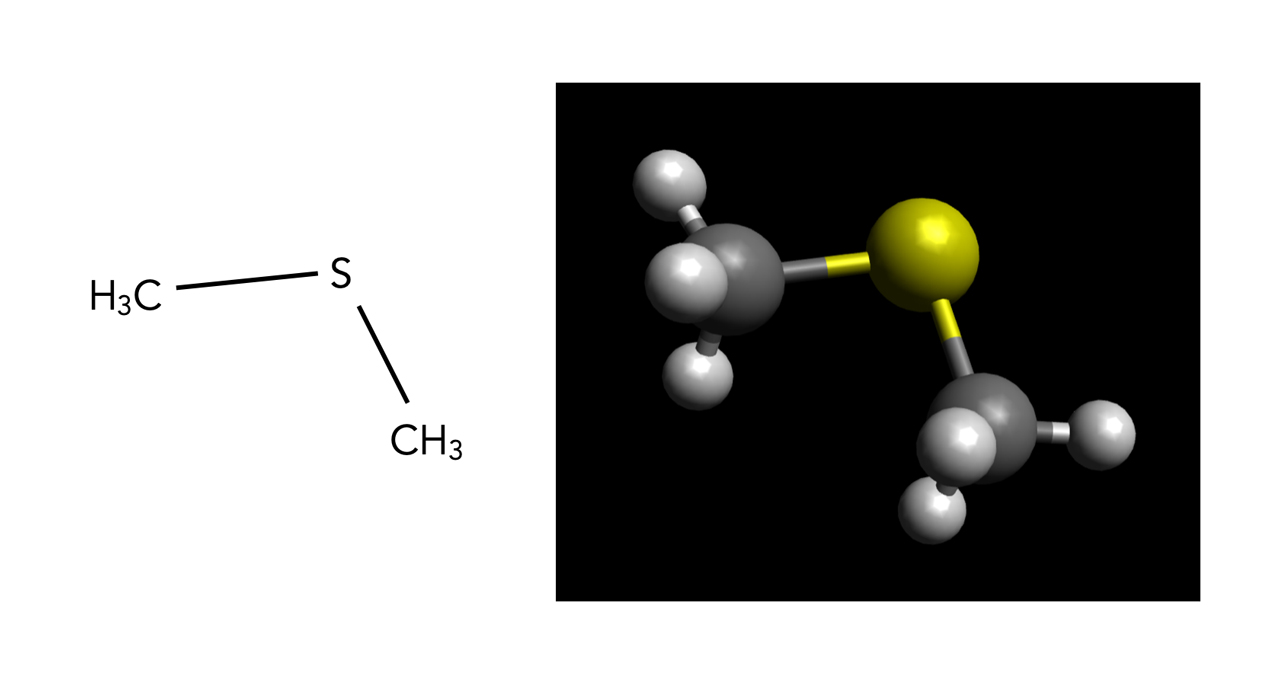
Das DMS-Molekül
Autor: Ulrich Helmich 2022, Lizenz: Public domain
James Lovelock meinte 1987, dass DMS ein Anti-Treibhausgas ist. Die Oxidationsprodukte von DMS wie SO2 bilden Aerosole, die als Keime für Wolkenbildung dienen. Die Wolken reflektieren Sonnenlicht, und das vermindert die Erwärmung der Atmosphäre [3].
"Wegen der riesigen Mengen an Phytoplanktonorganismen in den Meeren macht die Produktion von Dimethylsulfid etwa die Hälfte des biologischen Anteils des globalen Schwefelkreislaufs aus." [6]
Das Dimethylsulfid stammt weitgehend aus der organischen Verbindung Dimethylsulfoniumpropionat (DMSP).
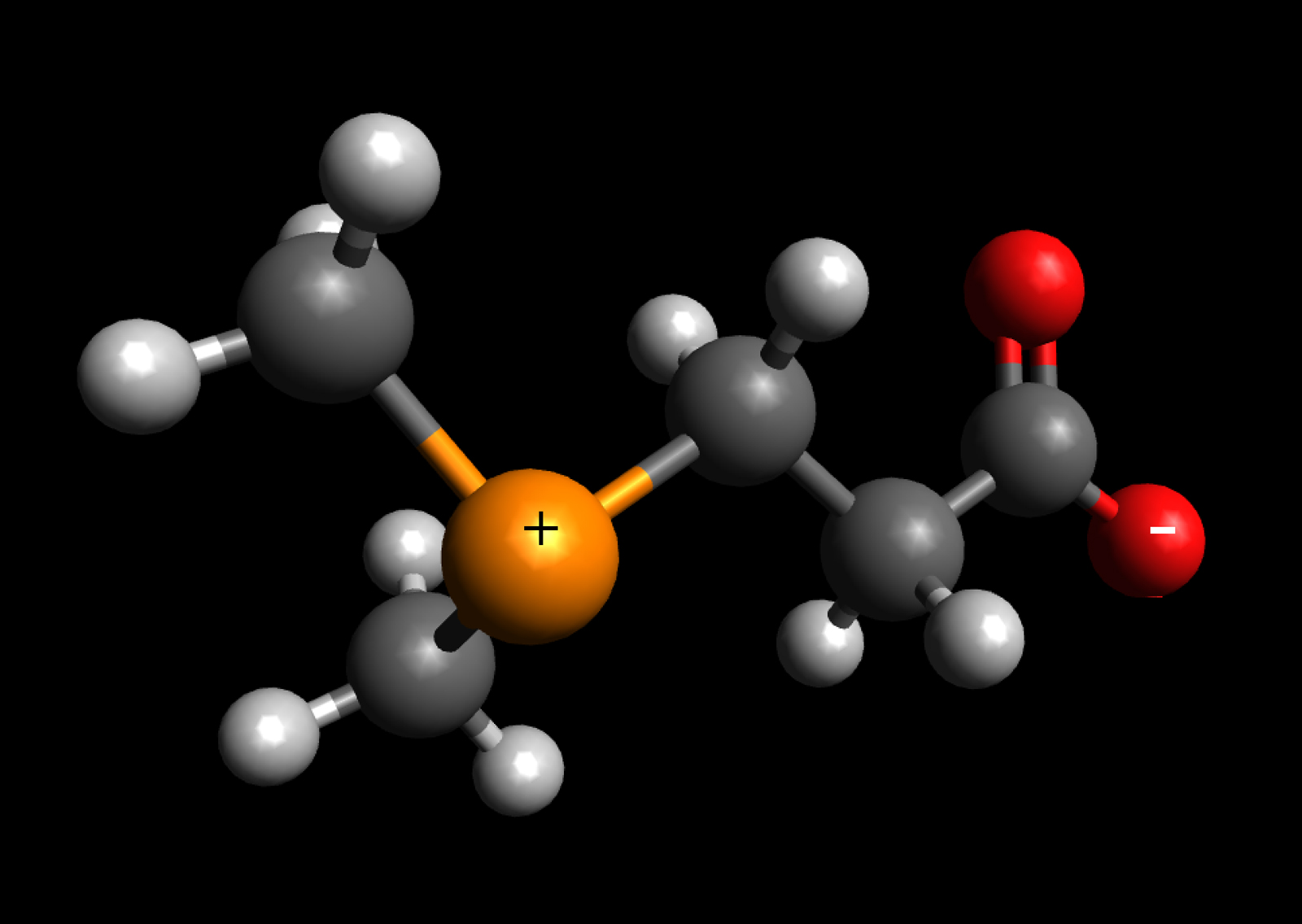
Dimethylsulfoniumpropionat
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Bei diesem Molekül handelt es sich um eine Propansäure CH3-CH2-COOH, die mit einem DMS-Molekül verbunden ist: (CH3)2-S+-CH3-CH2-COO-. Das Schwefel-Atom ist positiv geladen, das O-Atom der Carboxygruppe negativ. Es handelt sich also um ein Zwitterion.
Viele im Meer lebende Mikroorganismen, Eukaryoten und Prokaryoten, produzieren dieses DMSP teils in großen Mengen. Warum sie das machen, ist teils noch unklar, es gibt mehrere Hypothesen. Nach einer dieser Hypothesen dient das DMSP als Anti-Stress-Verbindung, vor allem in Umwelten mit hohem Salzgehalt und niedrigen Temperaturen. Nach einer anderen Hypothese hilft DMS bei der Regulation des osmotischen Drucks in den Zellen, mit Hilfe von DMS oder DMSP können das Phytoplankton sowie einige Algenarten ihren Salz- und Wasserhaushalt regulieren [6].
Beim Abbau von DMSP in den Organismen entsteht DMS, das in die Atmosphäre entweicht, und Propionat, das dann von anderen Lebewesen als Kohlenstoffquelle genutzt werden kann. Die Organismen bauen das DMSP mit Hilfe von speziellen Enzymen ab, von denen man inzwischen acht verschiedene gefunden hat.
2018 hat man dann weitere organische Schwefelverbindungen entdeckt, die eine Rolle im Schwefelkreislauf spielen können, vor allem den Stoff Dimethylsulfoxoniumpropionat
(DMSOP).
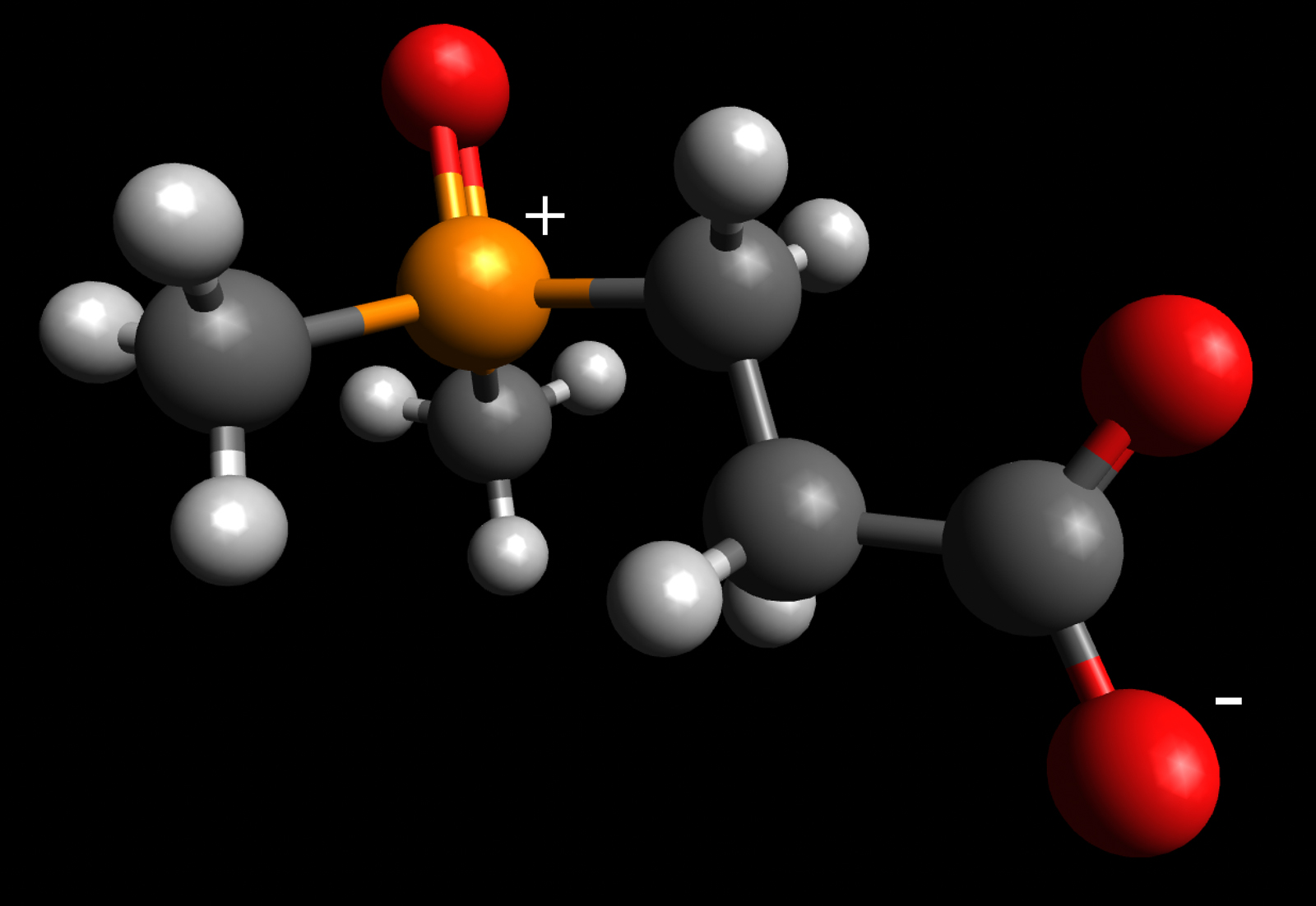
Dimethylsulfoxoniumpropionat
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Diese Verbindung wird von bestimmten Bakterien gebildet, von anderen Bakterien zu DMSP umgesetzt, das wieder von anderen Bakterien aufgenommen wird.
Ein großer Teil (über 30%) des DMS wird in der Atmosphäre zu Hydroperoxymethylthioformiat (HPMTF) oxidiert. Welchen Einfluss diese Verbindung auf das globale Klima hat, weiß man noch nicht [3].
Schwefeldioxid
Bei der Verbrennung fossiler Brennstoffe (Kohle, Erdöl) entsteht Schwefeldioxid SO2.
Dieses giftige Gas steigt in die Atmosphäre auf und verbindet sich dort mit Wasser zu schwefeliger Säure H2SO3, die durch den Luftsauerstoff weiter zu Schwefelsäure H2SO4 oxidiert werden kann. Verbindet sich das SO2 mit Stickstoffdioxid NO2, kann auch salpetrige Säure HNO2 und mit Hilfe von Sauerstoff auch die gefährlichere Salpetersäure HNO3 entstehen.
All diese Säuren sind Bestandteile des sauren Regens, der in Wäldern und Seen große Schäden verursachen kann.
Quellen:
- engl. Wikipedia, Artikel "Sulfur cycle".
- Wikipedia, Artikel "Schwefelkreislauf".
- Rachel Brazil: "Die Rätsel des Schwefelkreislaufs", Spektrum der Wissenschaft 9/22.
- Wikipedia, Artikel "Thiobacillus".
- Wikipedia, Artikel "Desulfurikation".
- Savada, Hillis, Heller, Hacker: Purves Biologie, Springer Verlag Deutschland 2019, 10. Auflage. Herausgegeben von Jürgen Markl.
- Kadereit , Körner, Nick, Sonnewald: Strasburger - Lehrbuch der Pflanzenwissenschaften, 38. Auflage, Springer Berlin Heidelberg 2021.